此外,没有切割活性的cas9(dCas9)仍然有识别结合靶序列的能力,这一特点也可以被巧妙利用于生物传感,例如将两个dCas9分别连接上分离荧光素酶的N端和C端,这两个dCas9的sgRNA被设计为识别结核分枝杆菌DNA上下游的序列片段。如果目标DNA存在,一对dCas9在目标序列上下游分别结合,荧光素酶得以重组,发出荧光信号用于检测(图1B)[9]。Guk等[10]在2017年报道了一种利用dCas9对靶标的高度亲和性检测耐甲氧西林金黄色葡萄球菌mecA基因的方法,给dCas9蛋白连接磁球,当dCas9捕捉结合靶标后,磁性分离出dCas9并用SYBR-GreenⅠ显色其结合的双链DNA,这种将CRISPR/Cas9与DNA荧光原位杂交联用的方法简单快速,并展现出相当好的灵敏度。
2.基于CRISPR/Cas13的感染性疾病核酸检测平台:Ⅵ型CRISPR系统包含一个名为Cas13a的“效应器”蛋白,其识别靶标类型是单链RNA而非DNA(图1C)。张锋团队利用其附属切割的特点建立起的第一个检测平台称为SHERLOCK[6]。在这个平台中,首先对靶标进行重组酶聚合酶扩增(recombinase polymerase amplification, RPA)或逆转录重组酶聚合酶扩增(reverse transcription-recombinase polymerase amplification, RT-RPA),然后再进行T7转录,靶标被扩增的同时也使得检测的靶标类型不局限于RNA。他们利用SHERLOCK成功对大肠埃希菌、铜绿假单胞菌、结核分枝杆菌、肺炎克雷伯菌和金黄色葡萄球菌进行了鉴定,并且区分出了肺炎克雷伯菌不同的耐药基因。基于SHERLOCK的检测方式检测耗时在2 h内,并且单次检测的成本低廉,为核酸检测开启了新篇章。在此基础上,张锋课题组还开发出了SHERLOCKv2[11],即SHERLOCK的二代版本,将Cas13a与Csm6(一种辅助的CRISPR Ⅲ型核酸酶)联用,两者协同作用使得信号得以增强,使检测灵敏度较一代提高了3.5倍。通过用稀释的等温扩增引物进行非饱和反应,从一代的定性检测变为相对定量检测。通过应用带有抗FAM抗体和金纳米粒子的纸基传感器,开发出了便携式试纸条。此外,通过将筛选出的在附属切割上有序列偏好的3种Cas13蛋白和1种Cas12a蛋白在一个体系中应用,实现了一个体系同时检测4种病原体。这4点性能的提升和突破使得SHERLOCK在感染性疾病检测上变得更加灵敏、实用、便携和高效,例如在医疗条件相对落后地区,不论是DNA、RNA还是细菌感染导致的肺炎都可以用这种方式进行检测,还可以进行人类免疫缺陷病毒滴度监测以指导抗病毒治疗等。从这些优势中足以预见这种新型分子诊断平台在感染性疾病诊断上有着极佳的前景。之后,张锋团队又将一种通过加热和化学还原的方式裂解病毒颗粒和灭活核糖核酸酶的样本预处理方法(HUDSON)添加到SHERLOCK样本处理步骤中,使得SHERLOCK可以直接用于从临床样本中检测病毒核酸,而省去提取和纯化的样本预处理步骤[12]。这进一步缩短了样本周转时间,简化了步骤,这对于将CRISPR/Cas用于病原体的实时快速检验有非常重要的意义。
3.基于CRISPR/Cas12的感染性疾病核酸检测平台:Ⅱ类V-A型Cas12蛋白也被发现具有反式切割活性,但与Cas13不同,Cas12靶向DNA并附属切割单链DNA(图1D)。利用Cas12首先开发出的平台包括HOLMES和DETECTR。Li等[5]用HOLMES检测DNA/RNA病毒,可在1 h内从细胞系或临床样本中检测病毒基因型和人类单核苷酸多态性(single nucleotide polymorphism, SNP),并且灵敏度也可达到阿摩尔级。之后的HOLMESv2利用Cas12b具有很宽的反式切割活性温度范围特点,将其与环介导的等温扩增方式相结合,实现了一个集靶标扩增和信号转化的“一锅式”核酸检测系统,支持定量检测靶DNA[13]。这是迄今为止用于RNA检测的最简单的CRISPR生物传感平台。Chen等[14]利用DETECTR快速准确地鉴定了各种亚型的HPV病毒。与SHERLOCK类似的是,HOLMES或是DETECTR都可以通过剪切荧光报告探针实现荧光信号检测或结合纸基传感策略实现肉眼可见的试纸条检测(图1E)。
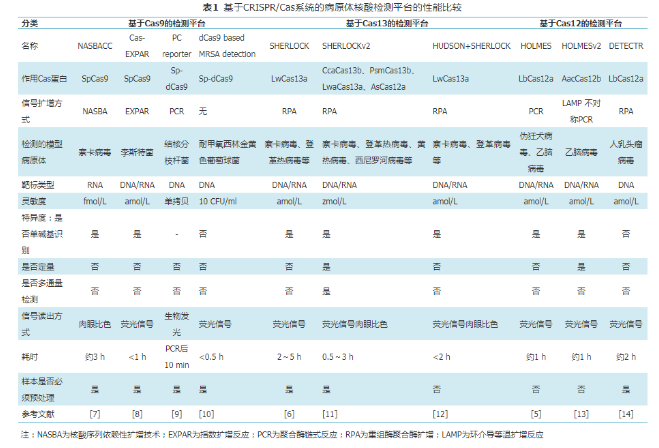
2019年,James课题组提出了一种对传统材料进行分子编程后用于生物传感的策略。他们将Cas12a-gRNA复合物嵌入连有单链DNA的晶格结构中制成水凝胶[15]。当水凝胶系统暴露于靶标DNA存在的环境中时,Cas12a被激活,其对周围单链DNA的反式切割使得水凝胶的骨架被剪切破坏,从而造成水凝胶的塌陷。在生物传感方面,用此策略检测了葡萄球菌的mecA基因片段,激活的Cas12剪切将淬灭荧光基团连接于凝胶骨架的单链DNA,导致荧光信号产生。他们还将水凝胶嵌入微流控纸质设备中,开发了一种可以对埃博拉病毒进行实施快速检测的试纸条,这种试纸条在实战中表现出相当好的灵敏度和可重复性。新颖的组合方式使得老材料用了新用法,这种创新的思路可以催生更多新颖的生物传感策略[16]。表1比较了上述具有代表性的基于CRISPR/Cas系统的病原体检测分子诊断平台的性能。
三、从新型冠状病毒肺炎(COVID-19)诊断中看CRISPR/Cas核酸检测平台的优势
2019年底,COVID-19疫情开始在全球范围内的多个国家暴发,这场疫情也为开发出的基于CRISPR/Cas的分子诊断平台提供了实战检验的机会。传统的基于RT-PCR的方法可在4~6 h内检测病毒,结果相对可靠,然而在面临传染性高、突变率高的感染性疾病时,局限性也更加凸显,其准确性和效率取决于样本采集部位是否有足够数量的病毒基因片段,采集的方法不对或者错过采集的窗口时间可能导致假阴性结果,这在大流行阶段是非常可怕的[17]。因此为了提高准确度必须反复检测,这会大大增加时间及其他附加成本。基于CRISPR/Cas的分子诊断平台则在一定程度上弥补了这些缺陷。
Chiu课题组将DETECTR开发用于2019-nCoV检测,将病毒编码包膜蛋白和核衣壳的基因作为检测的靶点。整个过程包括:在62 ℃下进行20~30 min的RT-LAMP和在37 ℃下进行10 min的Cas12检测反应,总用时大约30~40 min,并且是在试纸条上读取结果。包括RNA提取的整个过程大约45 min,检测限低至10拷贝数/μl,其准确度则与RT-PCR方法不相上下。更重要的是从病原体发现到开发出这样成熟的检测平台也只需要2周左右[18]。
而张锋团队则公布了使用SHERLOCK平台检测2019-nCoV的标准流程。他们选用S基因和Orf1ab基因两种2019-nCoV特异性序列作为检测靶点,整个检测过程包括核酸抽提扩增、Cas13反应以及试纸条检测,耗时在1 h以内,检测限同样低至10拷贝数/μl。但考虑到上述方法均需要分两步,核酸扩增到Cas反应需要转移样本,增加了污染概率,张锋和其他团队合作又开发出了另一种结合环介导等温扩增技术和Cas12b的2019-nCoV检测方式,命名为“STOP”(SHERLOCK testing in one pot)[19]。和HOLMESv2类似,该方法旨在实现等温扩增步骤和检测一步反应,减少前处理的步骤,简化流程,并使得样本转移更少,降低污染概率,从而进一步提升检测的准确度。
总之,上述3个检测平台在2019-nCoV的诊断中均表现出了良好的灵敏度和特异度,并且速度更快、操作更方便、适用范围更广、单次检测成本低廉,再次证明CRISPR/Cas核酸检测平台在传染病诊断中的优势和前景。
四、CRISPR/Cas系统应用于感染性疾病诊断的优势与局限及未来研究方向
CRISPR/Cas系统毫无疑问为感染性疾病的诊断提供了新的方法和契机,总结来说,它具有如下优点:(1)相较于基于PCR的传统方法,毫不逊色的灵敏度和特异度。(2)检测所需时间短。(3)简单便携,不依赖昂贵的仪器和严苛的实验环境。(4)试剂耐受冷冻干燥,便于储存和携带。(5)标本前处理可以非常简单。(6)结果读取方便,能通过荧光或者肉眼读取结果。这几大优点使得CRISPR检测平台可以对病原体核酸分子实现实时快速检测。
但是,CRISPR技术也有一些局限。第一,由于样本中靶标的低丰度,大多基于CRISPR的检测方式都需要结合特定的核酸扩增策略,尽管大部分是等温扩增,相对PCR更加简单,但这仍然是其向更加便捷、省时方向发展的阻碍。第二,CRISPR技术需要在病原体的基因序列完全清楚的情况下,才能设计gRNA开发出特异的核酸检测平台,这一点使得其在不明病原体引起的疾病流行初期能发挥的作用可能很有限。第三,由于CRISPR系统附属切割活性具有持续性和随意性,使得此检测平台在完全定量检测、细胞原位检测的应用上还有待突破。第四,实现类似于SHERLOCKv2一样更多种病原体的高通量检测难度较大。第五,脱靶效应的存在可能导致假阴性结果的产生。
因此根据以上几点也不难推测未来CRISPR技术的两大研究方向,第一,是新的Cas蛋白的开发及突变体的筛选鉴定。例如后来发现的Cas14蛋白,不同于Cas12和Cas13,其擅长识别单链DNA,丰富了CRISPR工具箱[20]。而具有不同切割特性的Cas蛋白的筛选鉴定为提高检测通量及降低“脱靶效应”提供了方法。第二是将CRISPR/Cas其和其他的技术平台结合起来,开发新颖实用的生物传感策略,比如将Cas9蛋白固定于石墨烯场效应晶体管[21],以及将Cas系统的报告探针固定于电极上,从而实现不需要使用信号扩增的电化学生物传感器的构建[22]。使用水凝胶作为其响应原件实现多样化的信号输出[15]。与微流体技术结合开发出的CARMAN技术,可以对数十个样本,上百种病毒进行快速检测,为解决通量低的问题提供了方法等[23]。不断地将新兴的材料与技术与CRISPR技术结合实现优势互补,开发出更实用新颖的生物传感策略用于感染性疾病诊断将是未来一段时间内的研究重点。
总之,CRISPR/Cas技术作为新兴的分子诊断策略,尽管有其局限,但其准确、灵敏、快速、廉价、便携的特点已经为核酸检测带来革命性变化,尤其在感染性疾病的检验诊断上有着无可比拟的优势,未来应用前景极佳。
相关产品:
|
货号 |
产品 |
规格 |
|
TABAS03KIT |
TwistAmp Basic Kit DNA扩增试剂盒 |
96T |
|
TAEXO02KIT |
TwistAmp exo 试剂盒 |
96T |
|
B8201C1 |
DNA恒温快速扩增试剂盒(DNA基础型) |
48T |
|
B8202C3 |
DNA恒温快速扩增试剂盒(DNA荧光型) |
48T |
|
B8203C5 |
DNA恒温快速扩增试剂盒(DNA试纸条型) |
48T |
|
B8204C7 |
RNA恒温快速扩增试剂盒(RNA基础型) |
48T |
|
B8205C9 |
RNA恒温快速扩增试剂盒(RNA荧光型) |
48T |
|
B8206C0 |
RNA恒温快速扩增试剂盒(RNA试纸条型) |
48T |
|
JY0209 |
双靶标HybriDetect侧向层析试纸条(彩虹型) |
50T |
|
JY0201 |
单靶标HybriDetect侧向层析试纸条(彩虹型) |
50T |
|
JY0307 |
CRISPR单酶切及扩增产物检测试纸条 |
50T |
|
JY0301 |
CRISPR Cas12/13 HybriDetect试纸条 |
50T |
|
JY0308 |
CRISPR双酶切检测试纸条(变色龙) |
50T |
————公司所有销售产品仅限科研,不做临床诊断。


